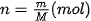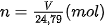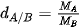(Trang 27)
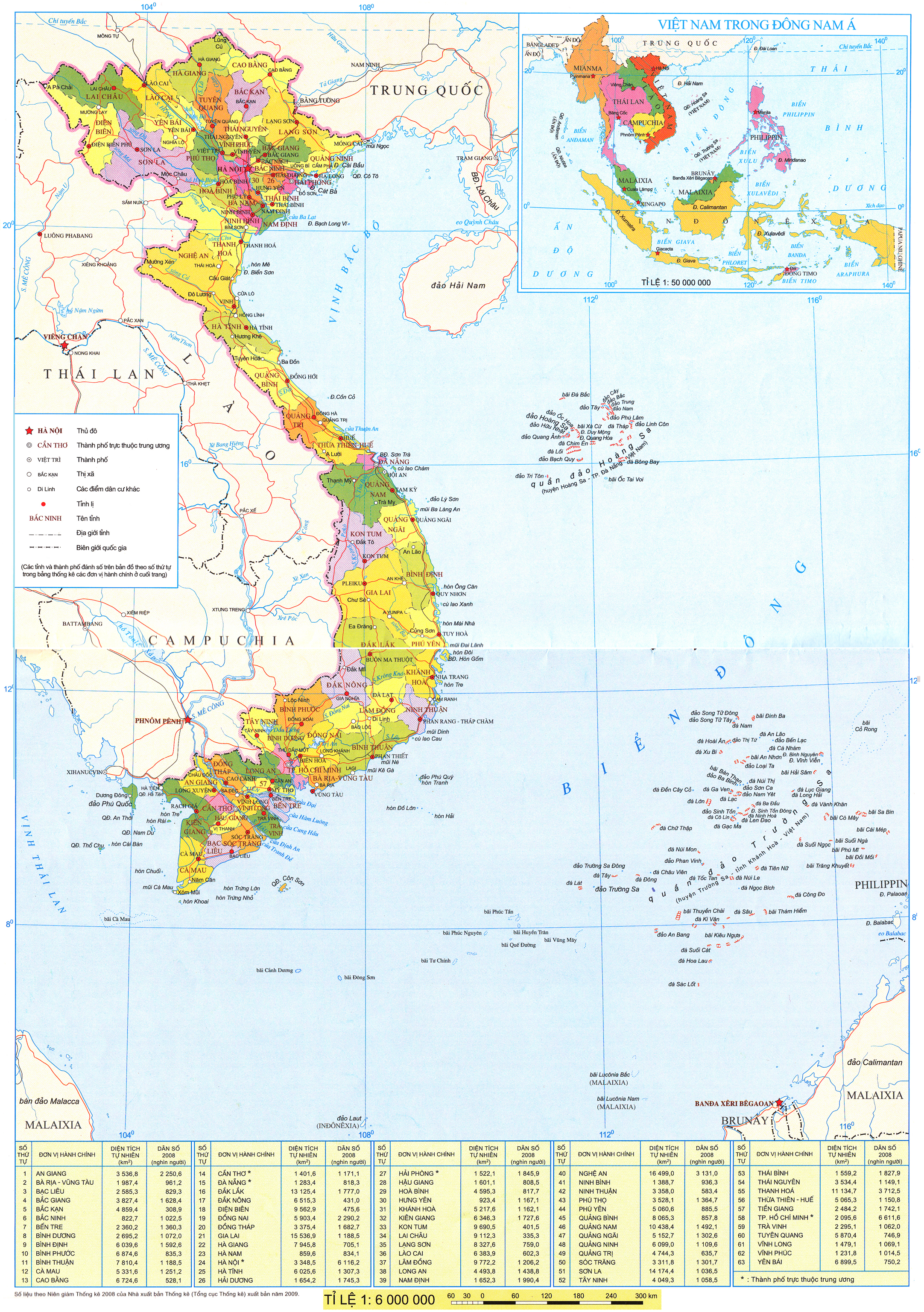
Học xong bài học này, em có thể:
• Nêu được khái niệm về mol (nguyên tử, phân tử).
• Tính được khối lượng mol (M); Chuyển đổi được giữa số mol (n) và khối lượng (m).
• Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí.
• So sánh được chất khí này nặng hay nhẹ hơn chất khí khác dựa vào công thức tính tỉ khối.
• Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 °C.
• Sử dụng được công thức 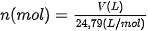 để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 °C.
để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 °C.
![]() Nếu yêu cầu đếm số lượng viên gạch để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được? Vì sao?
Nếu yêu cầu đếm số lượng viên gạch để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được? Vì sao?
Với những vật thể có kích thước và khối lượng đáng kể như viên gạch, quả táo,.., người ta dễ dàng xác định số lượng, khối lượng và thể tích của chúng bằng cách đếm, cân, đo,... Nhưng với những hạt có kích thước vô cùng nhỏ bé như nguyên tử, phân tử rất khó để có thể cân và đếm được chúng.
Vậy làm thế nào để có thể xác định một cách thuận lợi số nguyên tử, phân tử và khối lượng, thể tích của chúng khi tham gia và tạo thành trong các phản ứng hoá học?
|
Hình 4.1. Lâu dài bằng gạch |
Hình 4.2. Lâu đài bằng cát |
I. KHÁI NIỆM MOL
| Để xác định số nguyên tử, phân tử tham gia trong phản ứng hoá học, các nhà khoa học sử dụng đại lượng mol. Mol là lượng chất có chứa 6,022 × Số 6,022 × |
a) 2 mol aluminium b) 1,5 mol carbon |
(Trang 28)
| Ví dụ: • 1 mol phân tử nước ( |
Em có biết
Số Avogadro lớn như thế nào?
Nếu một máy đếm có thể đếm các nguyên tử với tốc độ 10 triệu nguyên tử mỗi giây thì sẽ mất khoảng 2 tỉ năm để đếm hết các nguyên tử trong một mol.
|
3. Dựa vào bảng tuần hoàn các nguyên tố hoá học, cho biết khối lượng mol nguyên tử hydrogen, nitrogen và magnesium.
Tìm hiểu thêm Giải thích vì sao khối lượng mol nguyên tử hay phân tử của một chất có cùng trị số với khối lượng nguyên tử hay phân tử chất đó tính theo đơn vị amu. | II. KHỐI LƯỢNG MOLChúng ta không thể cân khối lượng của một nguyên tử, phân tử bằng cân thông thường, nhưng chúng ta có thể cân khối lượng của 1 mol nguyên tử, phân tử. Ví dụ:
Hình 4.3. Khối lượng của N nguyên tử copper và N phân tử muối ăn Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó. Đơn vị khối lượng mol là gam/mol. Khối lượng mol nguyên tử hay phân tử của một chất có cùng trị số với khối lượng nguyên tử hay phân tử chất đó tính theo đơn vị amu. Ví dụ: • Khối lượng nguyên tử oxygen là 16 amu, khối lượng mol nguyên tử của oxygen là 16 gam/mol. • Khối lượng phân tử nước là 18 amu, khối lượng mol phân tử của nước là 18 gam/mol. |
(Trang 29)
III. CHUYỂN ĐỔI GIỮA SỐ MOL CHẤT VÀ KHỐI LƯỢNG
Ví dụ
Đốt cháy hoàn toàn 6 gam carbon trong khí oxygen. Tính số mol carbon đã bị đốt cháy, biết khối lượng mol của carbon là 12 gam/mol.
| Gọi số mol carbon cần tìm là n mol. Ta có: 1 mol carbon nặng 12 gam, n mol carbon nặng 6 gam. Vậy Như vậy, nếu đặt n là số mol chất, M là khối lượng mol chất và m là khối lượng chất, ta có công thức:
|
![]() 3. Hoàn thành những thông tin còn thiếu trong bảng sau:
3. Hoàn thành những thông tin còn thiếu trong bảng sau:
| Chất | Số mol (n) (mol) | Khối lượng mol (M) (gam/mol) | Khối lượng (m) (gam) | Cách tính |
| Aluminium | 0,2 | 27 | 5,4 | 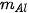 =0,2 x 27=5,4 (gam) =0,2 x 27=5,4 (gam) |
| Nước | 2 | ? | ? | ? |
| Khí oxygen | ? | ? | 16 | ? |
| Khí nitrogen | ? | ? | 18 | ? |
| Muối ăn | 0,4 | ? | ? | ? |
| Magnesium | ? | ? | 12 | ? |
IV. THỂ TÍCH MOL CỦA CHẤT KHÍ
Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó.
Các nhà khoa học đã xác định được rằng: Một mol của bất kì chất khí nào cũng chiếm những thể tích bằng nhau khi ở cùng điều kiện nhiệt độ và áp suất.
|
1 mol He |
1 mol |
1 mol |
Hình 4.4. Thể tích mol của một số khí ở 25 °C, 1 bar
Như vậy, những chất khí khác nhau luôn có thể tích mol bằng nhau (đo ở cùng điều kiện nhiệt độ và áp suất) dù khối lượng mol của chúng có thể không bằng nhau.
(Trang 30)
V. CHUYỂN ĐỔI GIỮA LƯỢNG CHẤT VÀ THỂ TÍCH CHẤT KHÍ
Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25 °C), mối liên hệ giữa thể tích và số mol chất khí oxygen được biểu diễn ở bảng 4.1.
Bảng 4.1. Mối liên hệ giữa thể tích và số mol khí
| Thể tích khí (lít) | 4,958 | 12,395 | 24,79 | 49,58 |
| Số mol khí (mol) | 0,2 | 0,5 | 1 | 2 |
Hãy rút ra các công thức chuyển đổi giữa số mol (n) và thể tích (V) của các chất khí ở điều kiện chuẩn (đkc).
Nếu đặt n là số mol chất khí, V là thể tích chất khí ở điều kiện chuẩn thì ta có biểu thức:
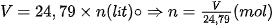 |
![]() 4. Hoàn thành những thông tin còn thiếu trong bảng sau:
4. Hoàn thành những thông tin còn thiếu trong bảng sau:
| Chất | Các đại lượng (đơn vị) | |||
| M (g/mol) | n (mol) | m (g) | V (L) (đkc) | |
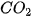 | ? | ? | 17,6 | ? |
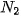 | ? | ? | ? | 4,958 |
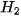 | ? | 0,5 | ? | ? |
|
6. Làm thế nào biết khí A nặng hay nhẹ hơn khí B? | VI. TỈ KHỐI CỦA CHẤT KHÍĐể so sánh khí A nặng hay nhẹ hơn khi B, người ta so sánh khối lượng của cùng một thể tích khí A và khí B trong cùng điều kiện nhiệt độ và áp suất. Tỉ khối của khí A so với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B. Tỉ khối của khí A so với khí B được kí hiệu là dA/B và được tính bằng biểu thức:
|
(Trang 31)
| Tỉ khối của khí A so với khí B cho biết khí A nặng hay nhẹ hơn khí B bao nhiêu lần. Ví dụ: Tỉ khối của khí
Tỉ khối của một khí với không khí Để biết khí X nặng hay nhẹ hơn không khí bao nhiêu lần, ta so sánh khối lượng mol của khí X ( Khối lượng mol trung bình của không khí xấp xỉ 29 gam/mol.
| 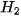 , , 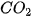 , , 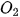 vào từng quả bóng bay trên. Điều gì sẽ xảy ra khi thả ba quả bóng bay đó trong không khí? vào từng quả bóng bay trên. Điều gì sẽ xảy ra khi thả ba quả bóng bay đó trong không khí? |
Em có biết
| Khinh khí cầu Khí cầu là một phương tiện bay trên không, hoạt động bằng đốt khí nóng hoặc chứa các khí nhẹ. Khinh khí cầu chứa các khí nhẹ như hydrogen, helium... có thể bay lên cao trong khí quyển do các khí đó có tỉ khối nhỏ hơn nhiều so với không khí và nhờ vào lực đẩy Archimedes (Acsimet). |
Khinh khí cầu |
• Mol là lượng chất có chứa 6,022 × • Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó. • Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó. Ở điều kiện chuẩn (áp suất 1 bar, nhiệt độ 25 °C), thể tích mol của các chất khí đều bằng 24,79 lít. • Công thức chuyển đổi giữa số mol (n) và thể tích của chất khí (V) ở điều kiện chuẩn:
|


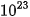 hạt vi mô (nguyên tử, phân tử,...) của chất đó.
hạt vi mô (nguyên tử, phân tử,...) của chất đó.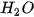 ) là lượng nước có chứa 6,022 x
) là lượng nước có chứa 6,022 x 
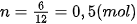 .
.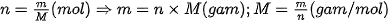


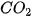

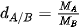
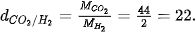
 )với khối lượng của 1 mol không khí.
)với khối lượng của 1 mol không khí.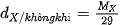

 nguyên tử hoặc phân tử của chất đó.
nguyên tử hoặc phân tử của chất đó.