(Trang 38)
MỤC TIÊU
- Tính được ΔH° một số phản ứng cháy, nổ để dự đoán mức độ mãnh liệt của phản ứng cháy, nổ.
- Tính được sự thay đổi của tốc độ phản ứng cháy, tốc độ phản ứng hô hấp theo giả định về sự phụ thuộc vào nồng độ oxygen.
| ? Phản ứng cháy, nổ đặc trưng bởi hiệu ứng toả nhiệt mạnh, tốc độ phản ứng nhanh, phản ứng trước cung cấp nhiệt cho phản ứng sau và xảy ra nối tiếp. Vậy, hiệu ứng nhiệt của phản ứng đốt cháy một số nhiên liệu phổ biến được xác định như thế nào và giá trị thu được có ý nghĩa gì? |
I. BIẾN THIÊN ENTHALPY CỦA MỘT SỐ PHẢN ỨNG CHÁY, NỔ
Việc xác định được biến thiên enthalpy của phản ứng cháy, nổ giúp sử dụng nhiên liệu tiết kiệm, an toàn và phòng tránh sự cố hoá hoạn.
Phần dưới đây trình bày cách tính biến thiên enthalpy 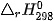 của một số phản ứng đốt cháy nhiên liệu phổ biến thông qua nhiệt tạo thành
của một số phản ứng đốt cháy nhiên liệu phổ biến thông qua nhiệt tạo thành 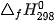 hoặc năng lượng liên kết (Eb).
hoặc năng lượng liên kết (Eb).
1. Đốt cháy than đá
Than đá được mệnh danh là “vàng đen” và được sử dụng làm nhiên liệu ở nhiều nhà máy nhiệt điện, ở các cơ sở sản xuất và hộ gia đình nước ta.
Phản ứng đốt cháy carbon trong than đá: 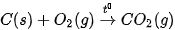
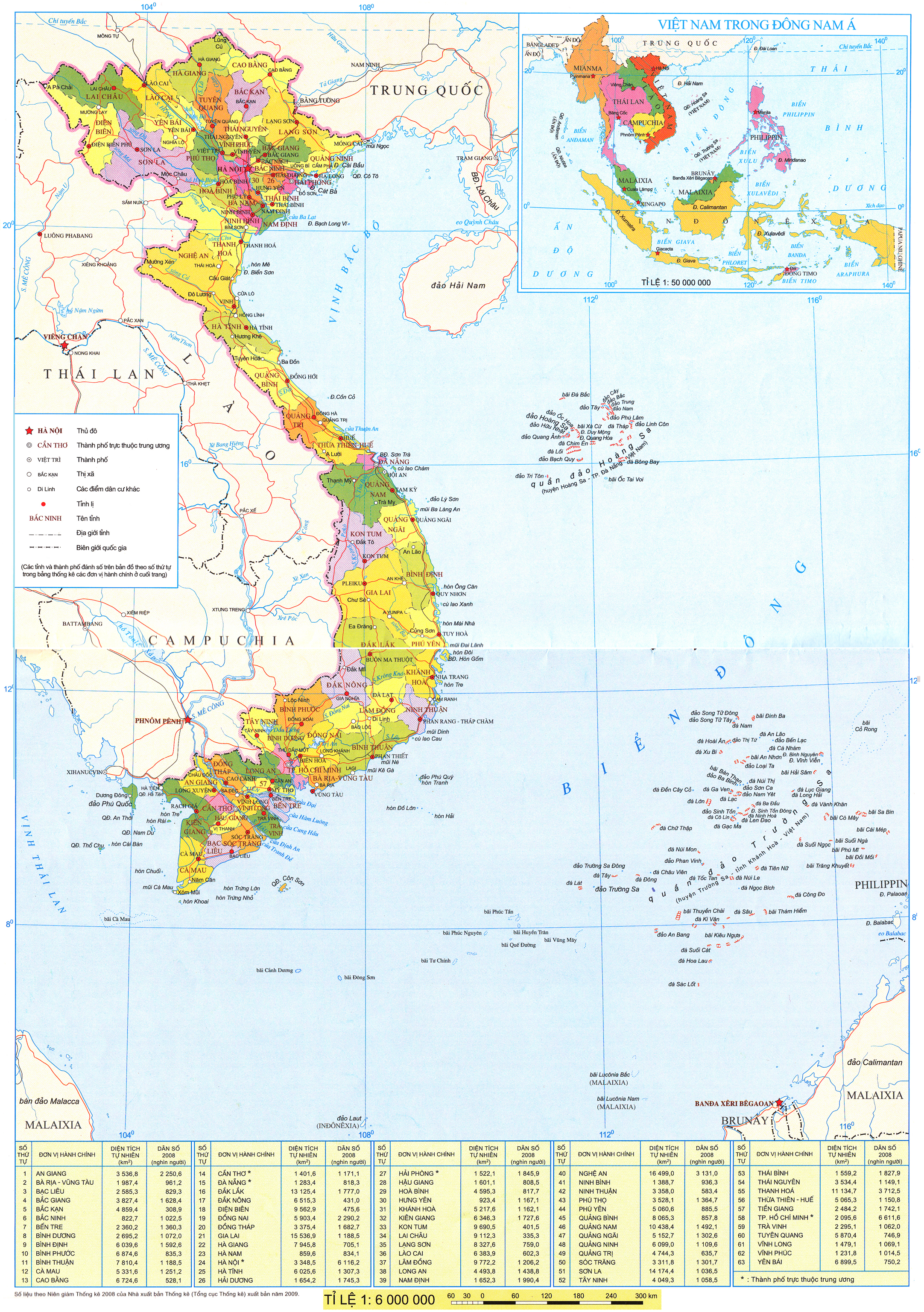
Biến thiên enthalpy 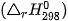 của phản ứng được tính thông qua các giá trị nhiệt tạo thành:
của phản ứng được tính thông qua các giá trị nhiệt tạo thành:
Chất | C(s) | O2(g) | CO2(g) |
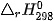 (kJ/mol) (kJ/mol) | 0 | 0 | –394 |
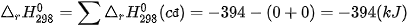
2. Đốt cháy khí thiên nhiên
Khí thiên nhiên (thành phần chính là methane) được dùng làm nhiên liệu ở nhà máy nhiệt điện khí và cung cấp chất đốt ở nhiều hộ gia đình vùng ôn đới.
Khí thiên nhiên được vận chuyển trong các đường ống dẫn khí và gây nguy cơ cháy nổ khi bị rò rỉ. Đặc biệt, methane gây ra một số vụ nổ lớn ở mỏ than khí gặp nguồn lửa.
(Trang 39)
Phản ứng đốt cháy methane:
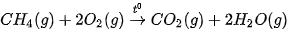
Biến thiên enthalpy chuẩn 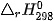 của phản ứng được tính thông qua các giá trị năng lượng liên kết (Eb):
của phản ứng được tính thông qua các giá trị năng lượng liên kết (Eb):
| Liên kết | C–H | O=O | C=O | O–H |
| Eb (kJ/mol) | 418 | 494 | 732 | 459 |
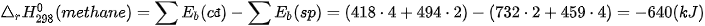
Khí thiên nhiên hiện nay còn được nén ở áp suất cao (compressed natural gas – CNG) để tiện bảo quản và sử dụng làm nhiên liệu cho phương tiện giao thông.
3. Đốt cháy gas
Gas được dùng khá phổ biến làm nhiên liệu đun nấu ở nhiều gia đình, có thành phần chính là propane (C3H8) và butane (C4H10). Ở 25 °C, gas tồn tại ở thể khí. Tuy nhiên, gas được hoá lỏng để tiện lợi khi bảo quản, vận chuyển và sử dụng.
Ví dụ: Đốt cháy một loại gas chứa propane và butane với tỉ lệ số mol tương ứng là 2 : 3.
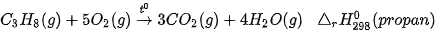
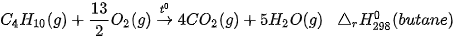
Biến thiên enthalpy chuẩn 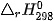 của phản ứng đốt cháy 1 mol gas được tính thông qua các giá trị năng lượng liên kết:
của phản ứng đốt cháy 1 mol gas được tính thông qua các giá trị năng lượng liên kết:
| Liên kết | C–H | C–C | O=O | C=O | O–H |
| Eb (kJ/mol) | 418 | 346 | 494 | 732 | 459 |
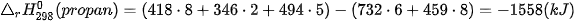
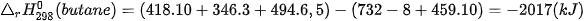
Biến thiên enthalpy chuẩn của phản ứng đốt cháy gas:
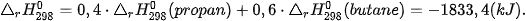
Như vậy, nhiệt lượng giải phóng ra khi đốt cháy 1 mol gas trên cao gấp gần 3 lần so với đốt cháy 1 mol methane.
4. Đốt cháy xăng
Xăng là hỗn hợp các hydrocarbon no có chứa từ 7 đến 12 nguyên tử carbon. Xăng được sử dụng làm nhiên liệu cho nhiều loại phương tiện có động cơ đốt trong như ô tô, xe máy.
Ví dụ: Phản ứng đốt cháy octane, chất có nhiều trong xăng.
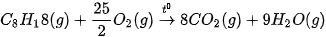
(Trang 40)
Biến thiên enthalpy chuẩn 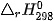 của phản ứng được tính thông qua các giá trị năng lượng liên kết:
của phản ứng được tính thông qua các giá trị năng lượng liên kết:
| Liên kết | C–H | C–C | O=O | C=O | O–H |
| Eb (kJ/mol) | 418 | 346 | 494 | 732 | 459 |
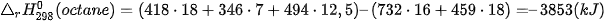
Phản ứng đốt cháy xăng toả ra nhiệt lượng lớn. Xăng là loại nhiên liệu phổ biến, kinh tế nhưng tiềm ẩn nhiều nguy cơ gây hoả hoạn.
5. Đốt cháy cồn
Cồn (ethanol) hiện được dùng để sản xuất xăng sinh học E5 (chứa 5% thể tích ethanol). Ngoài ra, cồn còn được dùng làm nhiên liệu cho đèn cồn, làm chất đốt để nướng thực phẩm ở nhiều gia đình.
Phản ứng đốt cháy ethanol:
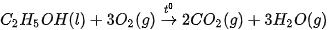
Biến thiên enthalpy chuẩn 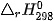 của phản ứng được tính thông qua các giá trị nhiệt tạo thành chuẩn:
của phản ứng được tính thông qua các giá trị nhiệt tạo thành chuẩn:
| Chất | C2H5OH(l) | O2(g) | CO2(g) | 3H2O(g) |
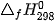 (kJ/mol) (kJ/mol) | –276 | 0 | –394 | –242 |
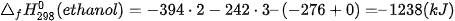
Phản ứng đốt cháy cồn toả rất nhiều nhiệt, do vậy cần hết sức cẩn thận khi bảo quản, vận chuyển và sử dụng cồn, đề phòng nguy cơ gây bỏng.
| ? 1. Xét phản ứng: CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) Tính nhiệt lượng toả ra khi đốt cháy CH4(g), biết 2. Tính nhiệt lượng toả ra khi đốt cháy 1 kg một loại củi khô, biết củi khô chứa 54% khối lượng cellulose và phần tử cellulose được cấu tạo bởi các gốc glucose. Giả thiết toàn bộ nhiệt lượng toả ra được tính từ biến thiên enthalpy của phản ứng đốt cháy glucose: C6H10O5(s) + 6O2(g) → 6CO2(g) + 5H2O(l) 3. Ngày 04 tháng 8 năm 2020 đã xảy ra một vụ nổ kinh hoàng ở nhà kho tại cảng Beirut của Lebanon. Đây là nhà kho chứa khoảng 2 700 tấn NH4NO3, một loại hoá chất vừa được sử dụng làm phân bón, vừa được dùng làm thuốc nổ do có khả năng phân huỷ thành khí và hơi, kèm theo toả nhiệt mạnh: a) Tính b) Tính nhiệt lượng toả ra giải phóng ra từ vụ nổ khi toàn bộ lượng NH4NO3 bị phân huỷ. |
(Trang 41)
II. TỐC ĐỘ PHẢN ỨNG CHÁY VÀ TỐC ĐỘ "PHẢN ỨNG HÔ HẤP"
1. Phản ứng đốt cháy
Xét phản ứng đốt cháy than đá trong không khí: C(s) + O2(g) → CO2(g)
Giả thiết tốc độ phản ứng phụ thuộc nồng độ oxygen trong không khí theo phương trình:
v = k · ![]()
Ở điều kiện thường, oxygen chiếm 21% thể tích không khí và có áp suất là 0,21 atm. Khi phần trăm thể tích oxygen trong không khí giảm từ 21% xuống 14% thì tốc độ phản ứng cháy sẽ giảm. Do nồng độ oxygen tỉ lệ thuận với phần trăm thể tích oxygen trong khí quyển nên tốc độ phản ứng cháy giảm so với điều kiện bình thường là:
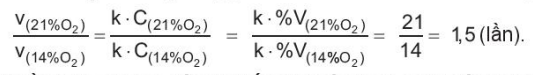
Như vậy, khi nồng độ oxygen giảm thì tốc độ phản ứng cháy giảm và nguyên tắc này được ứng dụng rộng rãi để dập tắt đám cháy.
2. "Phản ứng hô hấp"
Quá trình hô hấp cung cấp oxygen cho sự sống của các loài sinh vật. Đối với con người, việc hít thở không khí trong lành, giàu oxygen là yếu tố đặc biệt quan trọng giúp cho cơ thể khoẻ mạnh.
Xét "phản ứng hô hấp":
O2 (không khí) → O2 (cơ thể)
Giả thiết tốc độ "phản ứng hô hấp" phụ thuộc nồng độ oxygen trong không khí theo phương trình: v = k . ![]()
Ví dụ 1: Trong một phòng ngủ nhỏ và kín, phần trăm thể tích oxygen trong không khí lúc gần sáng giảm còn 18%.
Tốc độ "phản ứng hô hấp" giảm so với điều kiện bình thường là:
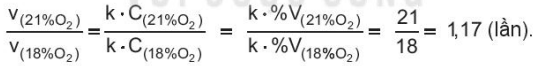
Ví dụ 2: Một bệnh nhân được điều trị trong buồng oxygen cao áp ở 25 °C với áp suất khí O2 là 2,52 atm.
Do nồng độ oxygen tỉ lệ thuận với áp suất nên tốc độ "phản ứng hô hấp" tăng so với điều kiện bình thường là:
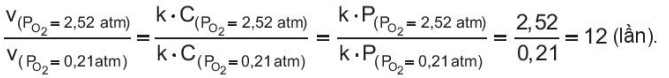
Con người thường bị thiếu oxygen khí ở lâu trong không gian kín, chật hẹp, ở trên cao, nơi tập trung đông người, nơi có nhiều khí thải, nơi diễn ra sự cháy... Việc giảm lượng oxygen sẽ ảnh hưởng đến tốc độ "phản ứng hô hấp" và tác động trực tiếp tới sức khoẻ.
(Trang 42)
Bảng 7.1. Ảnh hưởng của hàm lượng oxygen trong không khí tới sức khoẻ
| Phần trăm thể tích oxygen | Ảnh hưởng |
| 18% | Bắt đầu có cảm giác ngột ngạt |
| 16% | Tăng hô hấp, tăng nhịp tim, đau đầu, buồn nôn |
| 12% | Chóng mặt, mất thăng bằng |
| 10% | Sắc mặt xanh xao, bất tỉnh, ói mửa |
| 8% | Bất tỉnh, hôn mê |
| ? 4. Một người ngủ quên trong ô tô tắt máy, đóng kín cửa. Sau một thời gian, khi phần trăm thể tích oxygen giảm xuống còn 16% thì rất may có người kịp thời phát hiện, phá vỡ kính xe để đưa đi cấp cứu. Hỏi tại thời điểm đó người dân cứu, tốc độ "phản ứng hô hấp" của người trong xe giảm bao nhiêu lần so với bình thường? Giả thiết Vhô hấp = k . 5. Đỉnh Fansipan (có độ cao 3 147 m so với mực nước biển) là ngọn núi cao nhất Việt Nam. Giả thiết không khí trên đỉnh Fansipan có áp suất 0,66 atm và chứa 21% thể tích oxygen. Hỏi tốc độ "phản ứng hô hấp" giảm bao nhiêu lần so với điều kiện bình thường? Giả thiết Vhô hấp = k . |
| EM ĐÃ HỌC
|
| EM CÓ THỂ
|
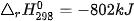
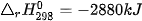
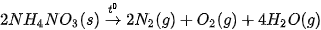
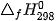 của NH4NO3(s) và
của NH4NO3(s) và