(Trang 19)
MỤC TIÊU
- Trình bày được khái niệm năng lượng hoạt hóa (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius:
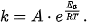
- Giải thích được vai trò của chất xúc tác.
| ? Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi đưa một ít bột platinium (Pt) vào hỗn hợp hai khí đó, phản ứng xảy ra ngay tức khắc, tạo thành nước. Yếu tố nào quyết định sự thay đổi đó? |
I. NĂNG LƯỢNG HOẠT HOÁ
1. Khái niệm năng lượng hoạt hoá
Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu mà các chất phản ứng cần có để phản ứng hóa học có thể xảy ra.
Để phản ứng hóa học xảy ra thì các phân tử chất phản ứng phải va chạm vào nhau, nhưng không phải mọi va chạm đều gây ra phản ứng, mà chỉ những va chạm có hiệu quả mới gây ra phản ứng (các va chạm có hiệu quả thường xảy ra giữa các phân tử có năng lượng đủ lớn (phân tử hoạt động), đó là năng lượng dư so với năng lượng trung bình của tất cả các phân tử.
Năng lượng hoạt hóa càng lớn, số phân tử hoạt động càng ít, số va chạm có hiệu quả càng nhỏ, dẫn đến tốc độ phản ứng càng nhỏ và ngược lại năng lượng hoạt hóa càng nhỏ, tốc độ phản ứng càng lớn.
2. Ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng
Mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng được biểu thị trong phương trình kinh nghiệm Arrhenius (A-re-ni-út):
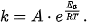
Trong đó:
A là hằng số đặc trưng cho mỗi phản ứng
e = 2,7183;
R là hằng số khí lí tưởng (R = 8,314 J/(mol.K))
T là nhiệt độ (theo thang Kelvin)
Ea là năng lượng hoạt hóa, đơn vị J/mol
(Trang 20)
Khi Ea càng lớn thì k càng nhỏ, tốc độ phản ứng càng nhỏ.
Tại nhiệt độ T1 và T2 tương ứng với hằng số tốc độ kT1 và kT2, phương trình Arrhenius được viết như sau:
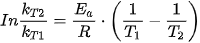
Ví dụ: Với phản ứng có năng lượng hoạt hoá Ea = 70 kJ/mol, khi tăng nhiệt độ từ 300 K đến 400 K, tốc độ phản ứng sẽ thay đổi như thế nào?
Lời giải:
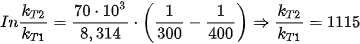
Như vậy khi nhiệt độ tăng từ 300 K đến 400 K thì tốc độ phản ứng tăng 1115 lần.
| ? 1. Cho phản ứng: 2NOCI(g) → 2NO(g) + Cl2(g), năng lượng hoạt hoá của phản ứng là 100 kJ/mol. Ở 350 K, hằng số tốc độ của phản ứng là 8-10-6 L/(mol.s). Tính hằng số tốc độ phản ứng ở 400 К. 2. Tính năng lượng hoạt hoá của một phản ứng biết rằng khi nhiệt độ tăng từ 300 K lên 310 K thì tốc độ phản ứng tăng 3 lần. 3. Thực nghiệm cho biết phản ứng: 2N2O5(g) → 4NO2(g)+ O2(g) ở 45 °C có hằng số tốc độ phản ứng là 8,17.10-3 s-1; E = 103,5 kJ/mol. Tính hằng số tốc độ phản ứng tại 65°C. |
II. CHẤT XÚC TÁC
1. Khái niệm chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi về chất và lượng sau phản ứng.
Ví dụ 1: Hỗn hợp bột aluminium và iodine ở nhiệt độ thường không có phản ứng xảy ra, nhưng khi cho thêm một ít nước làm xúc tác, phản ứng xảy ra mãnh liệt, tạo hợp chất aluminium iodide. Nước là chất xúc tác, không cùng trạng thái với chất phản ứng nên thuộc loại xúc tác dị thể.
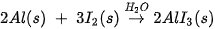
Vi dụ 2: Khi đun nóng SO2 với oxygen có mặt hỗn hợp (NO + NO2), thu được SO3. Các khí NO, NO2 là chất xúc tác có cùng trạng thái với chất phản ứng nên thuộc loại xúc tác đồng thể.
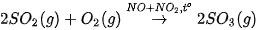
(Trang 21)
2. Đặc điểm của chất xúc tác
- Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng.
Hình 3.1 cho thấy xúc tác làm phản ứng xảy ra theo nhiều giai đoạn, mỗi giai đoạn đều có năng lượng hoạt hoá thấp hơn năng lượng hoạt hoá của phản ứng khi không có xúc tác, do đó làm tăng tốc độ phản ứng.
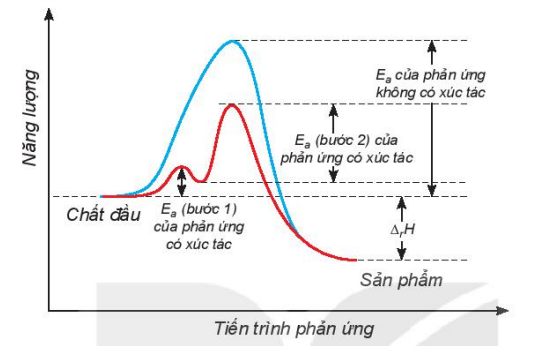
Hình 3.1. Ảnh hưởng của xúc tác đến năng lượng hoạt hoá
Năng lượng
Ea của phản ứng không có xúc tác
Ea (bước 2) của phản ứng có xúc tác
Chất đầu
Ea (bước 1) của phản ứng có xúc tác
- Chất xúc tác làm tăng tốc độ phản ứng và không làm thay đổi chiều của phản ứng hoá học.
- Chất xúc tác có tính chọn lọc, mỗi chất xúc tác thường chỉ có tác dụng đối với phản ứng này mà không có tác dụng với phản ứng khác.
Ví dụ: Enzyme xúc tác cho quá trình lên men đường thành acid lactic không làm xúc tác được cho quá trình lên men đường thành ethanol.
Enzyme ureaza xúc tác cho quá trình thuỷ phân urea:
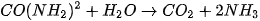
nhưng không xúc tác cho sự thuỷ phân các dẫn xuất của urea.
3. Vai trò của chất xúc tác
- Chất xúc tác được sử dụng làm tăng tốc độ các phản ứng hoá học trong sản xuất công nghiệp. Ví dụ: platinum (Pt), vanadium pentoxide (V2O5) được sử dụng trong quá trình oxi hoá SO2 thành SO3 để sản xuất sulfuric acid; bột iron (Fe) được hoạt hoá là xúc tác cho quá trình tổng hợp ammonia (NH3) từ nitrogen và hydrogen; platinum (Pt) dùng làm chất xúc tác cho quá trình oxi hoá ammonia (NH3) thành nitrogen oxide (NO) để sản xuất nitric acid.
- Quy trình sản xuất có thể được cải tiến bằng cách lựa chọn các chất xúc tác thích hợp. Sơ đồ dưới đây cho thấy từ nguyên liệu ethanol, tuỳ thuộc vào chất xúc tác được chọn và điều kiện phản ứng sẽ thu được các sản phẩm khác nhau.
(Trang 22)
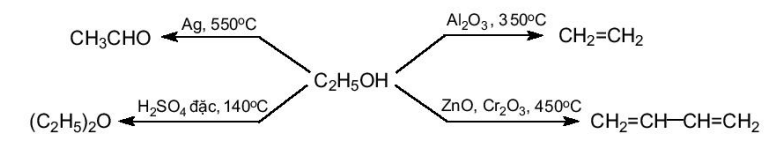
CH3CHO
Ag, 550°C
(C2H5)2O
H2SO4 đặc, 140°C
C2H5OH
Al2O3, 350°С
CH2=CH2
ZnO, Cr2O3, 450°C
CH2=CH-CH=CH2
Về mặt định lượng, có thể thấy vai trò của chất xúc tác khi áp dụng phương trình Arrhenius cho hai trường hợp có và không có xúc tác của cùng một phản ứng.
Kí hiệu hằng số tốc độ của phản ứng không có xúc tác là k0 và phần ứng có xúc tác là kx. Theo phương trình Arrhenius:
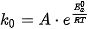
và 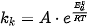
Ví dụ: Giả thiết một phần ứng xảy ra ở 600 K, khi có xúc tác năng lượng hoạt hoá giảm so với khi không có xúc tác là 41 900 J/mol.
Tỉ số: 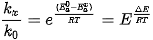
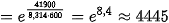
Như vậy, tốc độ phản ứng có xúc tác (kx) lớn hơn 4 445 lần tốc độ phản ứng không có xúc tác (k0).
| ? 4. Sự suy giảm tầng ozone và lỗ thủng tầng ozone (O3) đã gây ra mối lo ngại về việc gia tăng nguy cơ ung thư da, cháy nắng, mù mắt và đục thuỷ tinh thể,... Tầng ozone hấp thụ hầu hết các tia cực tím (UV) có hại cho sự sống trên Trái Đất. Các phân tử ozone có thể bị phá huỷ theo hai giai đoạn: CI + O3 → CIO + O2 và CIO + O3 → CI + 2O2 Chất xúc tác trong các quá trình này là chất nào? 5. Một phản ứng xảy ra ở 500 °C, năng lượng hoạt hoá của phản ứng khi không có xúc tác và khi có xúc tác lần lượt là 55,4 kJ/mol và 13,5 kJ/mol. Chứng minh rằng chất xúc tác có ảnh hường đến tốc độ phản ứng. |
(Trang 23)
| EM ĐÃ HỌC
|
| EM CÓ THỂ Vận dụng khái niệm năng lượng hoạt hoá để giải thích vai trò của xúc tác trong một số quá trình tự nhiên như: tiêu hoá thức ăn trong cơ thể người, động vật,... và một số quá trình sản xuất: sulfuric acid, acetic acid, rượu, bia,... |
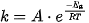 , khi Ea giảm hoặc T tăng thì k tăng nên tốc độ phản ứng tăng.
, khi Ea giảm hoặc T tăng thì k tăng nên tốc độ phản ứng tăng.