Mở đầu trang 119 Hóa học 11: Từ xa xưa con người đã biết lên men các loại ngũ cốc, hoa quả để tạo ra các đồ uống có cồn (có chứa ethanol – một alcohol quen thuộc). Ngày nay, alcohol được sử dụng phổ biến trong nhiều lĩnh vực khác nhau như làm dung môi, nguyên liệu hoá học, nhiên liệu, xăng sinh học, … Vậy alcohol là gì và có những tính chất đặc trưng nào?
Lời giải:
- Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (-OH) liên kết với nguyên tử carbon no.
- Tính chất đặc trưng của alcohol:
+ Phản ứng với các kim loại mạnh như sodium, potassium … giải phóng khí hydrogen.
+ Phản ứng tạo ether khi đun nóng alcohol với H2SO4 đặc ở khoảng 140oC.
+ Alcohol no, đơn chức, mạch hở bị tách nước tạo thành alkene.
+ Khi phản ứng với các tác nhân oxi hoá, ví dụ: CuO: alcohol bậc I bị oxi hoá thành aldehyde, alcohol bậc II bị oxi hoá thành ketone, alcohol bậc III không bị oxi hoá trong điều kiện này.
+ Các alcohol đều cháy, khi cháy toả nhiều nhiệt.
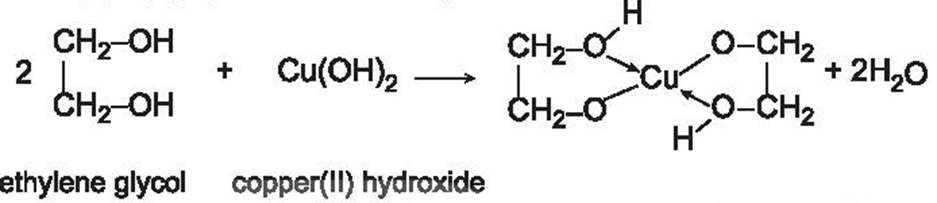
+ Ngoài ra, các polyalcohol có các nhóm -OH liền kề, có thể tác dụng với copper(II) hydroxide tạo thành dung dịch màu xanh lam đậm.
I. Khái niệm, danh pháp
Câu hỏi 1 trang 120 Hóa học 11: Viết các đồng phân cấu tạo của alcohol có công thức C4H9OH và xác định bậc của các alcohol đó.
Lời giải:
Các đồng phân cấu tạo của alcohol có công thức C4H9OH:
- Alcohol bậc I:
CH3 – CH2 – CH2 – CH2 – OH;
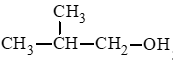
- Alcohol bậc II:
CH3 – CH(OH) – CH2 – CH3;
- Alcohol bậc III:
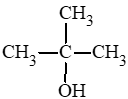
Câu hỏi 2 trang 121 Hóa học 11: Gọi tên theo danh pháp thay thế các alcohol dưới đây:
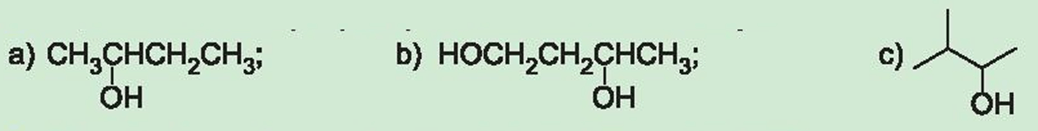
Lời giải:
Danh pháp thay thế của các alcohol:
a) Butan – 2 – ol;
b) Butane – 1,3 – diol;
c) 3 – methylbutan – 2 – ol.
Câu hỏi 3 trang 121 Hóa học 11: Viết công thức cấu tạo của các alcohol có tên gọi dưới đây:
a) pentan – 1 – ol;
b) but – 3 – en – 1 – ol;
c) 2 – methylpropan – 2 – ol;
d) butane – 2,3 – diol.
Lời giải:
a) pentan – 1 – ol:
CH3 – CH2 – CH2 – CH2 – CH2 – OH.
b) but – 3 – en – 1 – ol:
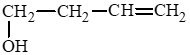
c) 2 – methylpropan – 2 – ol:
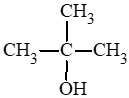
d) butane – 2,3 – diol:
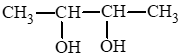
III. Tính chất vật lí
Hoạt động trang 122 Hóa học 11: Các hợp chất propane, dimethyl ether và ethanol có phân tử khối tương đương nhau và có một số tính chất như sau:
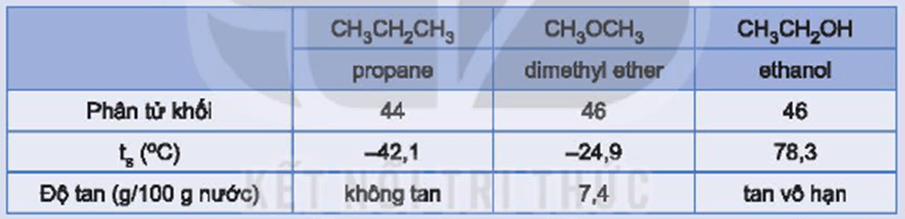
Hãy giải thích tại sao ethanol có nhiệt độ sôi cao hơn và tan trong nước tốt hơn so với hai chất còn lại.
Lời giải:
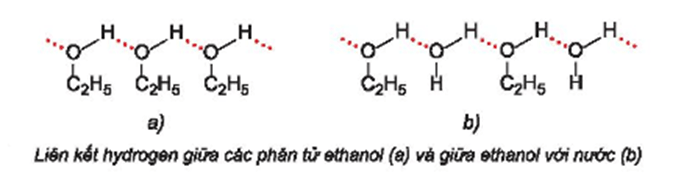
Dù có phân tử khối tương đương nhau nhưng ethanol có nhiệt độ sôi cao hơn và tan tốt trong nước hơn so với các hợp chất propane và dimethyl ether do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.
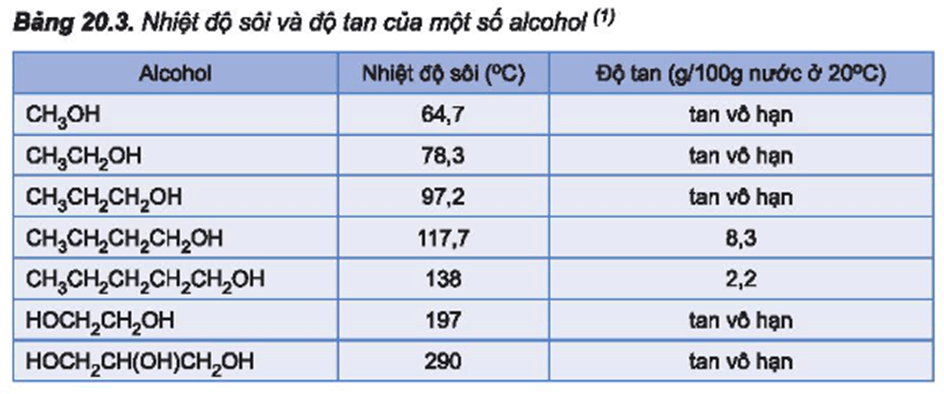
Câu hỏi 4 trang 123 Hóa học 11: Từ số liệu ở Bảng 20.3, em hãy giải thích tại sao trong dãy alcohol no, đơn chức, mạch hở, nhiệt độ sôi của các alcohol tăng dần từ C1 đến C5 còn độ tan trong nước giảm dần từ C3 đến C5.
Lời giải:
- Trong dãy alcohol no, đơn chức, mạch hở nhiệt độ sôi của các alcohol tăng dần từ C1 đến C5 do khối lượng phân tử tăng dần từ C1 đến C5.
- Trong dãy alcohol no, đơn chức, mạch hở độ tan trong nước giảm dần từ C3 đến C5 do gốc hydrocarbon là phần kị nước tăng lên.
IV. Tính chất hoá học
Câu hỏi 5 trang 124 Hóa học 11: Đun nóng butan – 2 – ol với sulfuric acid đặc thu được các alkene nào? Sản phẩm nào là sản phẩm chính.
Lời giải:
Đun nóng butan – 2 – ol (CH3 – CH(OH) – CH2 – CH3) thu được các alkene:
(1) CH2 = CH – CH2 – CH3;
(2) CH3 – CH = CH – CH3.
Sản phẩm (2) CH3 – CH = CH – CH3 là sản phẩm chính. Do phản ứng tách nước của alcohol tạo alkene ưu tiên theo quy tắc Zaisev: nhóm -OH bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
Câu hỏi 6 trang 124 Hóa học 11: Viết công thức cấu tạo sản phẩm của phản ứng khi oxi hoá các alcohol sau bằng CuO đun nóng:
![]()
Lời giải:
Ta có các sơ đồ:
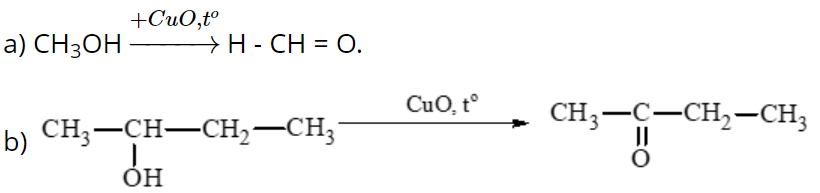
Hoạt động trang 124 Hóa học 11: Nghiên cứu về phản ứng cháy của alcohol
Chuẩn bị: cồn 90o (cồn y tế), bát sứ, que đóm dài khoảng 20 cm.
Tiến hành: Lấy khoảng 1 mL ethanol (chú ý không lấy nhiều hơn) cho vào bát sứ. Đốt cháy que đóm và đưa ngọn lửa vào gần miệng bát sứ để đốt cháy ethanol.
Lưu ý: Cẩn thận bỏng khi thực hiện thí nghiệm đốt cháy cồn.
Quan sát hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Đưa ngọn lửa que đóm vào gần miệng bát sứ cồn (ethanol) đã bắt cháy, cồn cháy mạnh trong không khí và toả nhiều nhiệt.
Phương trình hoá học minh hoạ:
C2H5OH + 3O2 → 2CO2 + 3H2O.
Hoạt động trang 125 Hóa học 11: Copper(II) hydroxide tác dụng với alcohol đa chức
Chuẩn bị: dung dịch CuSO4 2%, dung dịch NaOH 10%, ethanol, glycerol; 2 ống nghiệm.
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống khoảng 1 mL dung dịch CuSO4 2% và 1 mL dung dịch NaOH 10%.
- Lắc nhẹ 2 ống nghiệm rồi nhỏ vào từng ống:
Ống nghiệm (1): 5 giọt ethanol.
Ống nghiệm (2): 5 giọt glycerol.
- Lắc đều cả 2 ống nghiệm.
Quan sát hiện tượng xảy ra ở từng ống nghiệm, giải thích và viết phương trình hoá học.
Lời giải:
Hiện tượng:
+ Ống nghiệm (1): không có hiện tượng gì xuất hiện.
+ Ống nghiệm (2): Cu(OH)2 tan dần tạo ra dung dịch màu xanh lam đậm.
Câu hỏi 7 trang 125 Hóa học 11: Viết phương trình hoá học của phản ứng giữa methanol với sodium.
Lời giải:
2CH3OH + 2Na → 2CH3ONa + H2.
Câu hỏi 8 trang 125 Hóa học 11: Nêu phương pháp hoá học để phân biệt methanol và ethylene glycol.
Lời giải:
- Cho lần lượt từng dung dịch tác dụng với Cu(OH)2:
+ Không có hiện tượng xuất hiện → CH3OH.
+ Cu(OH)2 tan dần tạo dung dịch màu xanh lam đậm → ethylene glycol (C2H4(OH)2).
V. Ứng dụng
Câu hỏi 9 trang 127 Hóa học 11: Một đơn vị cồn tương đương 10 mL (hoặc 7,89 gam) ethanol nguyên chất. Theo khuyến cáo của ngành y tế, để đảm bảo sức khoẻ mỗi người trưởng thành không nên uống quá 2 đơn vị cồn mỗi ngày. Vậy mỗi người trưởng thành không nên uống quá bao nhiêu mL rượu 40o một ngày?
Lời giải:
Áp dụng công thức: Độ rượu ![]()
Thể tích ethanol nguyên chất có trong 2 đơn vị cồn là: 2 × 10 = 20 (mL).
Vậy người trưởng thành không nên uống quá: ![]() rượu 40o một ngày.
rượu 40o một ngày.
VI. Điều chế
Câu hỏi 10 trang 127 Hóa học 11: Viết phương trình hoá học của các phản ứng trong sơ đồ điều chế glycerol từ propylene.
Lời giải:
Trong công nghiệp, glycerol được tổng hợp từ propylene theo sơ đồ:
![]()
Các phương trình hoá học minh hoạ cho sơ đồ:
(1) CH2 = CH – CH3 + Cl2 → CH2 = CH – CH2Cl + HCl
(2) CH2 = CH – CH2Cl + Cl2 + H2O → CH2Cl – CH(OH) – CH2Cl + HCl
(3) CH2Cl – CH(OH) – CH2Cl + 2NaOH → CH2OH – CH(OH) – CH2OH + 2NaCl.