Biết tính chất, điều chế, ưng dụng của các oxit cacbon và muối cacbonat.
A - CACBON MONOOXIT
I - TÍNH CHẤT VẬT LÍ
Cacbon monooxit 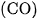 là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, rất ít tan trong nước, hoá lỏng ở
là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, rất ít tan trong nước, hoá lỏng ở 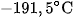 , hoá rắn ở -2
, hoá rắn ở -2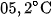 , rất bền với nhiệt. Khí CO rất độc.
, rất bền với nhiệt. Khí CO rất độc.
II - TÍNH CHẤT HOÁ HỌC
1. Cacbon monooxit là oxit không tạo muối (oxit trung tính)
CO không tác dụng với nước, axit và dung dịch kiềm ở điều kiện thường.
2. Tính khử
Khi đốt nóng, khí CO cháy trong oxi hoặc trong không khí, cho ngọn lửa màu lam nhạt và toả nhiều nhiệt :
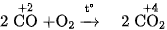
Vì vậy, khí CO được sử dụng làm nhiên liệu.
Ở nhiệt độ cao, khí CO khử được nhiều oxit kim loại.
Thí du : 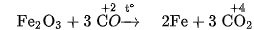
Tính chất này được dùng trong luyện kim để khử các oxit kim loại.
III - ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Khí CO được điều chế bằng cách đun nóng axit fomic 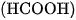 khi có mặt
khi có mặt 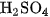 dặc :
dặc :
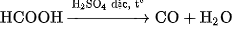
2. Trong công nghiệp
Khí CO thường được sản xuất bằng cách cho hơi nước đi qua than nung đỏ :
Hỗn hợp khí tạo thành được gọi là khí than uoớt, chứa trung bình khoảng 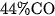 , còn lại là các khí khác như
, còn lại là các khí khác như 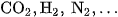
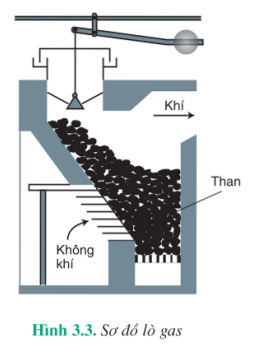
Khí CO còn được sản xuất trong các lò gas (hình 3.3) bằng cách thổi không khí qua than nung đỏ. Ở phần dưới của lò, cacbon cháy thành cacbon đioxit. Khi đi qua lớp than nung đỏ, 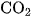 bị khử thành khí CO :
bị khử thành khí CO :
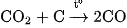
Hỗn hợp khí thu được gọi là khí lò gas (khí than khô). Trong khí lò gas, CO thường chiếm khoảng 25% , ngoài ra còn có 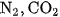 và một lượng nhỏ các khí khác.
và một lượng nhỏ các khí khác.
Khí than ướt, khí lò gas đều được dùng làm nhiên liệu khí.
B - CACBON ĐIOXIT
I - TíNH CHẤT VẬT Lí
Cacbon đioxit 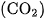 là chất khí không màu, nặng gấp 1,5 lần không khí, tan không nhiều trong nước : Ở điều kiện thường, 1 lít nước hoà tan được 1 lít khí
là chất khí không màu, nặng gấp 1,5 lần không khí, tan không nhiều trong nước : Ở điều kiện thường, 1 lít nước hoà tan được 1 lít khí 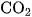 . Ở nhiệt độ thường, dưới áp suất 60 atm , khí
. Ở nhiệt độ thường, dưới áp suất 60 atm , khí 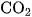 sẽ hoá thành chất lỏng không màu, linh động. Ở trạng thái rắn,
sẽ hoá thành chất lỏng không màu, linh động. Ở trạng thái rắn, 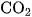 tạo thành một khối trắng, gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa , được dùng để tạo môi trường lạnh không có hơi ẩm.
tạo thành một khối trắng, gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa , được dùng để tạo môi trường lạnh không có hơi ẩm.
II - TÍNH CHẤT HOÁ HỌC
Khí 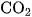 không cháy và không duy trì sự cháy của nhiều chất, nên người ta thường dùng những bình tạo khí
không cháy và không duy trì sự cháy của nhiều chất, nên người ta thường dùng những bình tạo khí 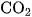 để dập tắt các đám cháy.
để dập tắt các đám cháy.
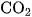 là oxit axit, khi tan trong nước tạo thành dung dịch axit cacbonic :
là oxit axit, khi tan trong nước tạo thành dung dịch axit cacbonic :
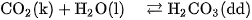
III - ĐIỀU CHẾ
1. Trong phòng thí nghiệm
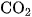 được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi :
được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi :
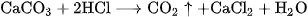
2. Trong công nghiệp
Khí 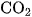 được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác. Ngoài ra, khí
được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác. Ngoài ra, khí 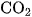 còn được thu hồi từ quá trình chuyển hoá khí thiên nhiên, các sản phẩm dầu mỏ, ... ; quá trình nung vôi ; quá trình lên men rượu từ đường glocozơ.
còn được thu hồi từ quá trình chuyển hoá khí thiên nhiên, các sản phẩm dầu mỏ, ... ; quá trình nung vôi ; quá trình lên men rượu từ đường glocozơ.
C - AXIT CACBONIC VÀ MUỐI CACBONAT
I - AXIT CACBONIC
Axit cacbonic 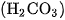 rất kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân huỷ thành
rất kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân huỷ thành 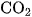 và
và 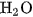 . Trong dung dịch, axit này phân li hai nấc, chủ yếu thành các ion
. Trong dung dịch, axit này phân li hai nấc, chủ yếu thành các ion 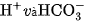 và chỉ tạo thành một lượng rất nhỏ
và chỉ tạo thành một lượng rất nhỏ 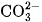 :
:
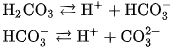
Axit cacbonic tạo ra hai loại muối : Muối cacbonat chứa ion 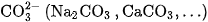 ; muối hiđrocacbonat chứa ion
; muối hiđrocacbonat chứa ion 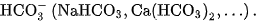
II - MUỐI CACBONAT
1. Tính chất
a) Tính tan
Muối cacbonat của kim loại kiềm, amoni và đa số các muối hiđrocacbonat dễ tan trong nước. Muối cacbonat của kim loại khác không tan trong nước.
b) Tác dụng với axit
Muối cacbonat, cũng như muối hiđrocacbonat, tác dụng dễ dàng với dung dịch axit, cho khí 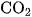 thoát ra.
thoát ra.
Thí dụ :
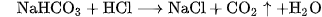
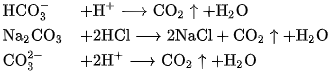
c) Tác dụng với dung dịch kiềm
Các muối hiđrocacbonat tác dụng dễ dàng với dung dịch kiềm.
Thí dụ : 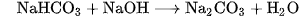

d) Phản ứng nhiệt phân
Muối cacbonat trung hoà của kim loại kiềm bền với nhiệt. Muối cacbonat trung hoà của kim loại khác, cũng như muối hiđrocacbonat, bị nhiệt phân huỷ.
Thí du :
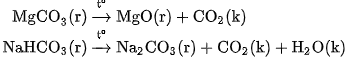
2. Ứng dụng
Canxi cacbonat 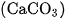 tinh khiết là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
tinh khiết là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
Natri cacbonat khan 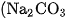 ), còn gọi là sođa khan) được dùng trong công nghiệp thuỷ tinh, đồ gốm, bột giặt, ...
), còn gọi là sođa khan) được dùng trong công nghiệp thuỷ tinh, đồ gốm, bột giặt, ...
Natri hidrocacbonat 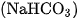 được dùng trong công nghiệp thực phẩm.
được dùng trong công nghiệp thực phẩm.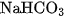 còn được dùng làm thuốc giảm đau dạ dày do thừa axit.
còn được dùng làm thuốc giảm đau dạ dày do thừa axit.
BÀI TẬP
1. Làm thế nào để loại hơi nước và khí 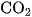 có lẫn trong khí CO ? Viết các phương trình hoá học.
có lẫn trong khí CO ? Viết các phương trình hoá học.
2. Có ba chất khí gồm 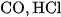 và
và 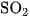 đựng trong ba bình riêng biệt. Trình bày phương pháp hoá học để phân biệt từng khí. Viết các phương trình hoá học.
đựng trong ba bình riêng biệt. Trình bày phương pháp hoá học để phân biệt từng khí. Viết các phương trình hoá học.
3. Điều nào sau đây không đúng cho phản ứng của khí CO với khí 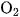 ?
?
A. Phản ứng thu nhiệt.
B. Phản ứng toả nhiệt.
D. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường.
4. a) Khi đun nóng dung dịch canxi hiđrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hoá học của phản ứng là
A. 4
B, 5
C. 6
D. 7
b) Khi cho dư khí 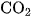 vào dung dịch chứa kết tủa canxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hoá học của phản ứng là
vào dung dịch chứa kết tủa canxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hoá học của phản ứng là
A. 4
D. 5
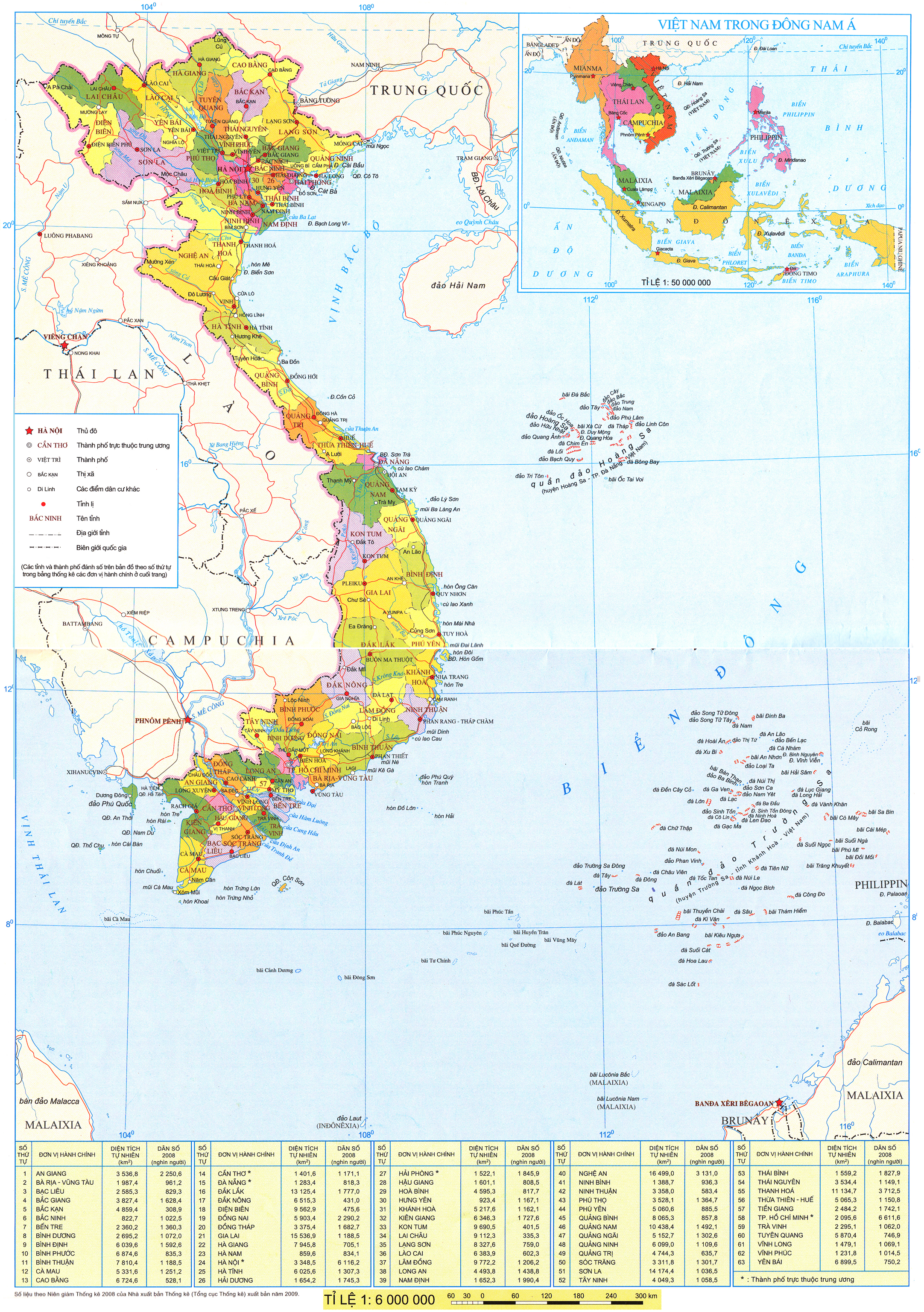
D. 6
D. 7
5. Cho 224,0 ml khí 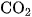 (đktc) hấp thụ hết trong 100,0 ml dung dịch kali hiđroxit 0,200M . Tính khối lượng của những chất có trong dung dịch tạo thành.
(đktc) hấp thụ hết trong 100,0 ml dung dịch kali hiđroxit 0,200M . Tính khối lượng của những chất có trong dung dịch tạo thành.
6. Nung 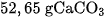 ở
ở 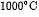 và cho toàn bộ lượng khí thoát ra hấp thụ hết vào
và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 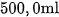 dung dịch
dung dịch 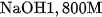 . Hỏi thu được những muối nào ? Khối lượng là bao nhiêu ? Biết rằng hiệu suất của phản ứng nhiệt phân
. Hỏi thu được những muối nào ? Khối lượng là bao nhiêu ? Biết rằng hiệu suất của phản ứng nhiệt phân 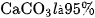 .
.