- Củng cố các kiến thức về axit - bazơ và về điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li.
- Rèn luyện kĩ năng thực hành thí nghiệm trong ống nghiệm và với lượng nhỏ hoá chất.
I - NỘI DUNG THÍ NGHIỆM VÀ CÁCH TIẾN HÀNH
Thí nghiệm 1. Tính axit - bazo
a) Đặt một mẩu giấy chỉ thị pH lên mặt kính đồng hồ. Nhỏ lên mẩu giấy đó một giọt dung dịch 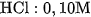 . So sánh màu của mẩu giấy với mẫu chuẩn để biết giá trị pH .
. So sánh màu của mẩu giấy với mẫu chuẩn để biết giá trị pH .
b) Làm tương tự như trên, nhưng thay dung dịch HCl lần lượt bằng từng dung dịch sau : 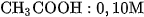 ;
; 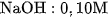 ;
; 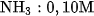 . Giải thích.
. Giải thích.
Thí nghiệm 2. Phản ứng trao đổi ion trong dung dịch các chất điện li
a) Cho khoảng 2 ml dung dịch 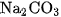 đặc vào ống nghiệm đựng khoảng 2 ml dung dịch
đặc vào ống nghiệm đựng khoảng 2 ml dung dịch 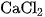 đặc. Nhận xét hiện tượng xảy ra.
đặc. Nhận xét hiện tượng xảy ra.
b) Hoà tan kết tủa thu được ở thí nghiệm a) bằng dung dịch HCl loãng. Nhận xét các hiện tượng xảy ra.
c) Một ống nghiệm đựng khoảng 2 ml dung dịch NaOH loãng. Nhỏ vào đó vài giọt dung dịch phenolphtalein. Nhận xét màu của dung dịch. Nhỏ từ từ dung dịch HCl loãng vào ống nghiệm trên, vừa nhỏ vừa lắc cho đến khi mất màu. Giải thích hiện tượng xảy ra.
Hãy viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm trên dưới dạng phân tử và dạng ion rút gọn.
II - VIẾT TƯỜNG TRÌNH
BÀI ĐỌC THÊM
ĐỘ ĐIỆN LI VÀ HẰNG SỐ PHÂN LI
I - ĐỘ ĐIỆN LI
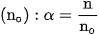
Thí dụ, độ điện li của \mathrm{CH}_{3} \mathrm{COOH} trong dung dịch nồng độ 0,043 \mathrm{~mol} / \mathrm{l} là 0,02 hay 2 \% , nghĩa là trong dung dịch này cứ 100 phân tử \mathrm{CH}_{3} \mathrm{COOH} hoà tan có 2 phân tử phân li ra ion, còn lại 98 phân tử không phân li ra ion :
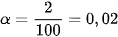
Như vậy, theo định nghĩa về độ điện li thì chất điện li mạnh có 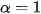 , chất điện li yếu có
, chất điện li yếu có 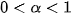 . Chất có \alpha=0 là chất không điện li.
. Chất có \alpha=0 là chất không điện li.
Khi pha loãng dung dịch thì độ điện li của các chất điện li đều tăng. Thí dụ : ở 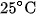 , độ điện li của
, độ điện li của 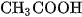 trong dung dịch
trong dung dịch 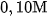 là 1,32 % , trong dung dịch
là 1,32 % , trong dung dịch 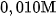 là 4,11 % .
là 4,11 % .
II - HẰNG SỐ PHÂN LI
Sự phân li của chất điện li yếu trong dung dịch là quá trình thuận nghịch. Khi nào tốc độ phân li và tốc độ kết hợp các ion tạo lại phân tử bằng nhau, cân bằng của quá trình điện li được thiết lập. Giống như mọi cân bằng hoá học khác, cân bằng điện li cũng có hằng số cân bằng. Thí dụ, 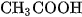 là axit yếu, trong dung dịch có cân bằng sau :
là axit yếu, trong dung dịch có cân bằng sau :
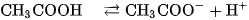
Ở trạng thái cân bằng, nồng độ 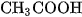 và nồng độ các ion
và nồng độ các ion 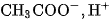 không biến đổi nên ta có :
không biến đổi nên ta có :
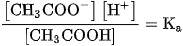
Ở đây 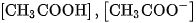 và
và 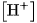 là nồng độ mol của
là nồng độ mol của 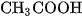 ,
, 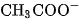 và
và 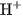 ở trạng thái cân bằng.
ở trạng thái cân bằng.
Hằng số cân bằng K , trong trường hợp này được gọi là hăng số phân li axit \mathrm{K}_{\mathrm{a}} . Giá trị của hằng số 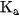 chỉ phụ thuộc vào bản chất axit và nhiệt độ.
chỉ phụ thuộc vào bản chất axit và nhiệt độ.
Giá trị 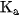 của axit càng nhỏ, lực axit của nó càng yếu. Thí dụ : ở
của axit càng nhỏ, lực axit của nó càng yếu. Thí dụ : ở 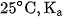 của
của là
là 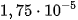 và của HClO là
và của HClO là 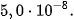 Vậy lực axit của HClO yếu hơn so với lực axit của
Vậy lực axit của HClO yếu hơn so với lực axit của 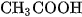 , nghĩa là nếu hai axit này có cùng nồng độ mol và ở cùng nhiệt độ thì nồng độ mol của
, nghĩa là nếu hai axit này có cùng nồng độ mol và ở cùng nhiệt độ thì nồng độ mol của 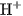 trong dung dịch HClO nhỏ hơn. Bazơ yếu cũng có hằng số phân li bazơ
trong dung dịch HClO nhỏ hơn. Bazơ yếu cũng có hằng số phân li bazơ 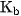 .
.
Giá trị của hằng số 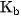 cũng chỉ phụ thuộc vào bản chất bazơ và nhiệt độ.
cũng chỉ phụ thuộc vào bản chất bazơ và nhiệt độ.