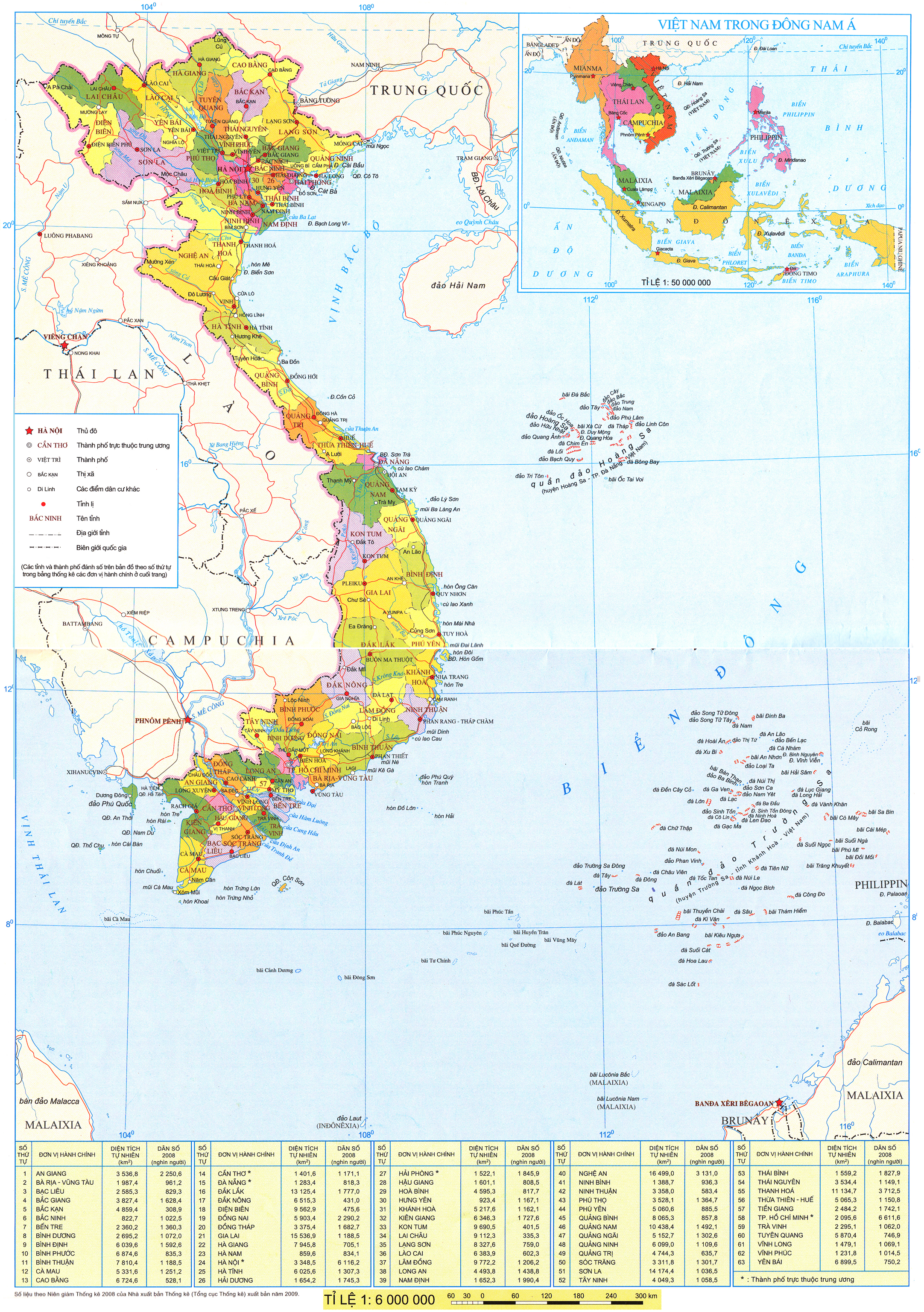
- Viết được cấu hình electron của nguyên tứ nitơ và cấu tạo phân tử của nó.
- Biết các tính chất vật lí, hoá học, ứng dụng và điều chế nitơ.
I - VỊ TRÍ VÀ CẤU HìNH ELECTRON NGUYÊN TỬ
Nitơ ở ô thứ 7 , nhóm VA, chu kì 2 của bảng tuần hoàn.
Cấu hình electron nguyên tử của nitơ là 
Ba electron ở phân lớp 2 p có thể tạo được ba liên kết cộng hoá trị với các nguyên tử khác.
Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba.
Công thức cấu tạo của phân tử nitơ là 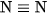 .
.
II - TÍNH CHẤT VẬT Lí
Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hoá lỏng ở  Khí nitơ tan rất ít trong nước (ở điều kiện thường, 1 lít nước hoà tan được 0,015 lít khí nitơ). Nitơ không duy trì sự cháy và sự hô hấp.
Khí nitơ tan rất ít trong nước (ở điều kiện thường, 1 lít nước hoà tan được 0,015 lít khí nitơ). Nitơ không duy trì sự cháy và sự hô hấp.
III - TÍNH CHẤT HOÁ HỌC
Liên kết ba trong phân tử nitơ rất bền, ở  nó vẫn chưa bị phân huỷ rõ rệt thành các nguyên tử. Ở nhiệt độ thường, nitơ khá trơ về mặt hoá học, nhưng ở nhiệt độ cao nitơ trở nên hoạt động hơn và có thể tác dụng được với nhiều chất.
nó vẫn chưa bị phân huỷ rõ rệt thành các nguyên tử. Ở nhiệt độ thường, nitơ khá trơ về mặt hoá học, nhưng ở nhiệt độ cao nitơ trở nên hoạt động hơn và có thể tác dụng được với nhiều chất.
Trong các hợp chất cộng hoá trị của nitơ với những nguyên tố có độ âm điện nhỏ hơn (như hiđro, kim loại,...), nguyên tố nitơ có số oxi hoá - 3 . Còn trong các hợp chất cộng hoá trị của nitơ với những nguyên tố có độ âm điện lớn hơn (oxi, flo), nguyên tố nitơ có số oxi hoá dương, có thể từ +1 đến +5 .
Khi tham gia phản ứng oxi hoá - khử, số oxi hoá của nitơ có thể giảm hoặc tăng, do đó nó thể hiện tính oxi hoá hoặc tính khử. Tuy nhiên, tính oxi hoá vẫn là tính chất chủ yếu của nitơ.
1. Tính oxi hoá
a) Tác dụng vói kim loại
Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như 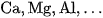 tạo thành nitrua kim loại.
tạo thành nitrua kim loại.
Thí dụ :
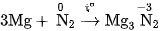
b) Tác dụng với hialro
Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ tác dụng trực tiếp với hiđro, tạo ra khí amoniac.
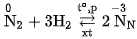
Trong những phản ứng nêu trên, số oxi hoá của nguyên tố nitơ giảm từ 0 dến -3 , nitơ thể hiện tính oxi hoá.
2. Tính khử
Ở nhiệt độ khoảng 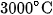 (hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi, tạo ra khí nitơ monooxit NO :
(hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi, tạo ra khí nitơ monooxit NO :
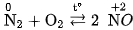
Trong phản ứng này, số oxi hoá của nitơ tăng từ 0 đến +2 , nitơ thể hiện tính khử. Trong thiên nhiên, khí NO được tạo thành khi có sấm sét (hình 2.1).

Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi của không khí, tạo ra khí nitơ đioxit 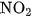 màu nâu đỏ :
màu nâu đỏ :
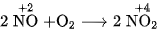
Ngoài các oxit trên, còn có các oxit khác của nitơ như 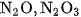 ,
,  , chúng không điều chế được bằng tác dụng trực tiếp giữa nitợ và oxi.
, chúng không điều chế được bằng tác dụng trực tiếp giữa nitợ và oxi.
IV - ỨNG DỤNG
Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật.
Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm, ...
Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử, ... sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
V - TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên, nitơ tồn tại ở dạng tự do và dạng hợp chất. Ở dạng tự do, khí nitở chiếm 78,16 % thể tích của không khí, hoặc gần đúng có thể coi khí nitơ chiếm 4 / 5 thể tích của không khí. Nitơ thiên nhiên là hỗn hợp của hai đồng vị : 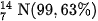 và
và 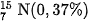 .
.
Ở dạng hợp chất, nitơ có nhiều t
VI - ĐIỀU CHẾ
1. Trong công nghiệp
Nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ  và hơi nước, không khí được hoá lỏng dưới áp suất cao và nhiệt độ rất thấp. Nâng nhiệt độ không khí lỏng đến
và hơi nước, không khí được hoá lỏng dưới áp suất cao và nhiệt độ rất thấp. Nâng nhiệt độ không khí lỏng đến 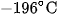 thì nitơ sôi và được lấy ra, còn lại là oxi lỏng, vì oxi lỏng có nhiệt độ sôi cao hơn
thì nitơ sôi và được lấy ra, còn lại là oxi lỏng, vì oxi lỏng có nhiệt độ sôi cao hơn  . Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
. Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
2. Trong phòng thí nghiệm
Một lượng nhỏ nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch bão hoà muối amoni nitrit :
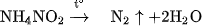
Muối này kém bền, có thể được thay thế bằng dung dịch bão hoà của amoni clorua và natri nitrit :
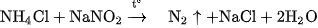
BÀI TẬP
1. Trình bày cấu tạo của phân tử 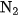 . Vì sao ở điều kiện thường, nitơ là một chất trơ ? Ở điều kiện nào nitơ trở nên hoạt động hơn ?
. Vì sao ở điều kiện thường, nitơ là một chất trơ ? Ở điều kiện nào nitơ trở nên hoạt động hơn ?
2. Nitơ không duy trì sự hô hấp, nitơ có phải là khí độc không ?
3. a) Cạap công thức của liti nitrua và nhôm nitrua là
A. 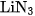 và
và  .
.
B. 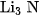 và AIN .
và AIN .
C. 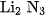 và
và 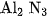 .
.
D. 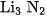 và
và 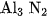 .
.
b) Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử ?
4. Nguyên tố nitơ có số oxi hoá là bao nhiêu trong các hợp chất sau: 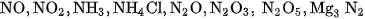 ?
?
5. Cần lấy bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lít khí amoniac ? Biết rằng thể tích của các khí đều được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25 % .