(Trang 12)
Mô hình vật liệu carbon nanotube
Tại sao đồng dẫn điện mà gỗ lại cách điện? Tại sao thép rất cứng mà vẫn dát mỏng và kéo sợi được? Từ hiểu biết về cấu tạo nguyên tử, các nhà khoa học không chỉ giải thích được tinh chất của vật liệu mà còn tạo ra nhiều vật liệu mới với những tính chất mới.
| • Thành phần của nguyên tử • Nguyên tố hoá học • Cấu trúc lớp vỏ electron nguyên tử • Ôn tập |
(Trang 13)
MỤC TIÊU:
– Trình bày được thành phần của nguyên tử (nguyên tử vô cùng nhỏ; nguyên tử gồm 2 phần: hạt nhân và lớp vỏ nguyên tử; hạt nhân tạo nên bởi các hạt proton (p), neutron (n); lớp vỏ tạo nên bởi các electron (e); điện tích, khối lượng mỗi loại hạt).
– So sánh được khối lượng của electron với proton và neutron, kích thước của hạt nhân với kích thước nguyên tử.
| Nguyên tử gồm các loại hạt cơ bản nào? Các nhà khoa học đã phát hiện ra các loại hạt cơ bản đó như thế nào? |
I. CÁC LOẠI HẠT CẤU TẠO NÊN NGUYÊN TỬ
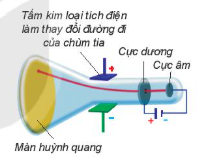
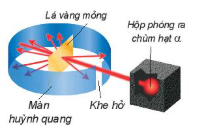
| Năm 1897, J. J. Thomson (Tôm-xơn, người Anh) thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm (xem Hình 1.1). Đó chính là chùm các hạt electron. Electron là một thành phần của nguyên tử. Năm 1911, E. Rutherford (Rơ-dơ-pho, người Niu Di-lân) thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt α (*) (alpha) (Hình 1.2). Ông sử dụng màn huỳnh quang bao quanh lá vàng để quan sát vị trí va chạm của hạt α. Kết quả thí nghiệm cho thấy hầu hết các hạt α đều xuyên thẳng qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử. Năm 1918, E. Rutherford và các cộng sự khi dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton. Năm 1932, J. Chadwick (Chat-uých, người Anh), cộng sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α. Proton, neutron và electron là các hạt cấu tạo nên nguyên tử (trừ trường hợp |
Hình 1.1. Thí nghiệm phát hiện hạt electron Tấm kim loại tích điện làm thay đổi đường đi của chùm tia Màn huỳnh quang Cực dương Cực âm
Hình 1.2. Thí nghiệm phát hiện hạt nhân nguyên tử Lá vàng mỏng Hộp phóng ra chùm hạt α Màn huỳnh quang Khe hở |
--------------------------------------------------------------------------------
(*) Hạt α: hạt nhân helium, mang điện tích dương.
(**) 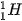 là một loại nguyên tử của nguyên tố hydrogen (sẽ được học trong bài Nguyên tố hoá học).
là một loại nguyên tử của nguyên tố hydrogen (sẽ được học trong bài Nguyên tố hoá học).
(Trang 14)
Thành phần cấu tạo của nguyên tử gồm:
– Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp 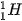 ).
).
– Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Bảng 1.1. Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử
| Hạt | Kí hiệu | Khối lượng (kg) | Khối lượng (amu) | Điện tích (C) | Điện tích tương đối |
| Proton | p | 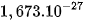 | ≈ 1 | 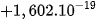 | +1 |
| Neutron | n | 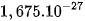 | ≈ 1 | 0 | 0 |
| Electron | e | 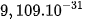 | 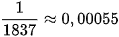 | 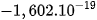 | –1 |
Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hoà về điện.
Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
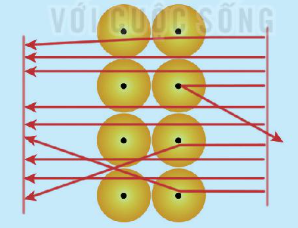
| 1. Nguyên tử chứa những hạt mang điện là A. proton và hạt α. B. proton và neutron. C. proton và electron. D. electron và neutron. 2. Quan sát hình ảnh mô phỏng kết quả thí nghiệm bắn phá lá vàng thực hiện bởi Rutherford (Hình 1.3) và nhận xét về đường đi của các hạt α.
Hình 1.3. Mô phỏng kết quả thí nghiệm bắn phá lá vàng |
(Trang 15)
II. KÍCH THƯỚC VÀ KHỐI LƯỢNG CỦA NGUYÊN TỬ
1. Kích thước
Kích thước của nguyên tử là khoảng không gian tạo bởi sự chuyển động của các electron. Các nguyên tử khác nhau có số electron khác nhau nên có kích thước khác nhau. Nếu coi nguyên tử như một khối cầu thì đường kính của nó chỉ khoảng 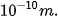
Kích thước nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Ångström (Å). 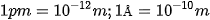 . Nguyên tử hydrogen có bán kính khoảng 53 pm.
. Nguyên tử hydrogen có bán kính khoảng 53 pm.
Hạt nhân nguyên tử có đường kính khoảng 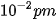 , kích thước nhỏ hơn nhiều so với kích thước nguyên tử.
, kích thước nhỏ hơn nhiều so với kích thước nguyên tử.
2. Khối lượngKhối lượng nguyên tử bằng tổng khối lượng các hạt proton, neutron và electron có trong nguyên tử. Khối lượng nguyên tử rất nhỏ nên một lượng chất rất nhỏ cũng chứa tới hàng tỉ tỉ nguyên tử. Ví dụ: Trong 2 g carbon chứa khoảng Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu. | EM CÓ BIẾT Một lượng chất rất nhỏ cũng chứa số nguyên tử lớn tới mức khó hình dung được. Ví dụ: trong 1 lít nước chứa khoảng |
Ví dụ: Một nguyên tử oxygen có khối lượng là 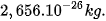
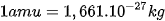 nên khối lượng một nguyên tử oxygen là 15,990 amu.
nên khối lượng một nguyên tử oxygen là 15,990 amu.
| EM CÓ BIẾT Khối lượng tính ra kg của 1 nguyên tử carbon-12 là 1 amu được định nghĩa bằng
|
| 3. Nếu phóng đại một nguyên tử vàng lên 1 tỉ 4. Một loại nguyên tử nitrogen có 7 proton và 7 neutron trong hạt nhân. Dựa vào Bảng 1.1, hãy tính và so sánh: a) Khối lượng hạt nhân với khối lượng nguyên tử. b) Khối lượng hạt nhân với khối lượng vỏ nguyên tử. |
(Trang 16)
III. ĐIỆN TÍCH HẠT NHÂN VÀ SỐ KHỐI
Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử Na có 11 proton nên số đơn vị điện tích hạt nhân là Z = 11.
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Ví dụ: Hạt nhân nguyên tử Na có số proton là 11 và số neutron là 12 nên số khối của hạt nhân nguyên tử Na là:
A = 11 + 12 = 23
| 5. Aluminium (nhôm) là kim loại phổ biến nhất trên vỏ Trái Đất, được sử dụng trong các ngành xây dựng, ngành điện hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử aluminium có điện tích bằng +13 và số khối bằng 27. Tính số proton, số neutron và số electron có trong nguyên tử aluminium. |
| EM ĐÃ HỌC • Nguyên tử vô cùng nhỏ nhưng được tạo thành từ các hạt nhỏ hơn, gồm hạt nhân (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa các electron mang điện tích âm). Nguyên tử trung hoà về điện. Trong nguyên tử, số proton bằng số electron. • Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron). • Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử. |
| EM CÓ THỂ Vận dụng phương pháp mô hình để mô tả cấu tạo nguyên tử. |
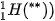 .
.
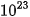 nguyên tử carbon.
nguyên tử carbon.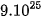 các nguyên tử oxygen và hydrogen. Do đó, không thể nhìn thấy nguyên tử bằng mắt thường, thậm chí bằng kính hiển vi có độ phóng đại rất lớn (hàng chục triệu lần).
các nguyên tử oxygen và hydrogen. Do đó, không thể nhìn thấy nguyên tử bằng mắt thường, thậm chí bằng kính hiển vi có độ phóng đại rất lớn (hàng chục triệu lần).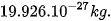
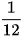 khối lượng 1 nguyên tử carbon-12:
khối lượng 1 nguyên tử carbon-12: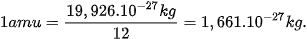
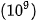 lần thì kích thước của nó tương đương một quả bóng rổ (có đường kính 30 cm) và kích thước của hạt nhân tương đương một hạt cát (có đường kính 0,003 cm). Hãy cho biết kích thước nguyên tử vàng lớn hơn so với hạt nhân bao nhiêu lần.
lần thì kích thước của nó tương đương một quả bóng rổ (có đường kính 30 cm) và kích thước của hạt nhân tương đương một hạt cát (có đường kính 0,003 cm). Hãy cho biết kích thước nguyên tử vàng lớn hơn so với hạt nhân bao nhiêu lần.