(Trang 55)
I. HỆ THỐNG HOÁ KIẾN THỨC
| NITROGEN | SULFUR • SULFUR DIOXIDE |
- Nitrogen là nguyên tố phổ biến, góp phần tạo nên sự sống trên Trái Đất.
- Cấu hình electron lớp ngoài cùng của nguyên từ: 2s22p3.
- Số oxi hoá thường gặp:
-3, 0, +1, +2, +3, +4, +5. - Phân từ nitrogen gồm 2 nguyên từ liên kết với nhau bằng liên kết ba bền vững (NEN).
- Đơn chất nitrogen khá trơ ở nhiệt độ thường, hoạt động hoá học mạnh hơn khi đun nóng và có xúc tác.
- Đơn chất nitrogen thể hiện tính oxi hoá và tính khử.
| Sulfur - Sulfur là nguyên tố phổ biến trên Trái Đất, tồn tại ở cả dạng đơn chất và hợp chất.
- Cấu hình electron lớp ngoài cùng: 3s²3p4.
- Số oxi hoá thường gặp: -2, 0, +4, +6.
- Phân từ dạng mạch vòng gồm 8 nguyên từ (S8) và tương đối bền.
- Sulfur thể hiện cả tính oxi hoá và tính khử.
- lưu huỳnh đioxit
- Sulfur dioxide phát thải ra môi trường từ quá trình đốt cháy nhiên liệu (than đá, dầu mỏ), đốt cháy sulfur và khoáng vật sulfide....
- Sulfur dioxide có tính chất của oxide acid, có tính oxi hoá và tính khử.
|
| AMONIA • MUỐI AMONIUM | SULFURIC ACID • MUỐI SULFATE |
| Amoniac - Phân tử ammonia có dạng chóp tam giác, phân tử còn 1 cặp electron không liên kết.
- Khí ammonia có mùi khai, dễ tan trong nước, dễ hoá lỏng; ammonia có tính base và tính khử.
- Ammonia được sản xuất từ nitrogen và hydrogen theo quá trình Haber-Bosch.
Muối ammonium - Muối ammonium thường dễ tan trong nước và kém bền nhiệt.
- lon ammonium được nhận biết bằng phản ứng với kiểm, sinh ra khi có mùi khai.
| Sulfuric acid - Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh.
- Dung dịch sulfuric acid đặc có tính hảo nước, có khả năng gây bỏng, có tính acid mạnh và tính oxi hoá mạnh.
- Bảo quản, sử dụng sulfuric acid đặc phải tuân theo quy tắc đảm bảo an toàn, phòng chống cháy, nổ.
- Sulfuric acid được sản xuất từ các nguyên liệu chính: sulfur, quặng pyrite.
Muối sulfate - Các muối sulfate có nhiều ứng dụng thực tiễn: ammonium sulfate, barium sulfate, calcium sulfate, magnesium sulfate....
- lon sulfate trong dung dịch được nhận biết bằng ion Ba2+.
|
(Trang 56)
| MỘT SỐ HỢP CHẤT VỚI OXYGEN CỦA NITROGEN Oxide của nitrogen - Các oxide của nitrogen là một trong số các tác nhân chính gây ô nhiễm không khí và gây mura acid.
Axit nitric - Nitric acid là chất lỏng, tan tốt trong nước, bốc khói trong không khí ẩm.
- Nitric acid có tính acid mạnh và tính oxi hoá mạnh.
|
II. LUYỆN TẬP
Câu 1. Phân tử nitrogen có cấu tạo là

Câu 2. Phân tử ammonia có dạng hình học nào sau đây?
A. Chóp tam giác.
B. Chữ T.
C. Chóp tứ giác.
D. Tam giác đều.
Câu 3. Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây?
A. H2O B. HCl C. H3PO4. D. O2 (Pt, t°)
Câu 4. Khi so sánh phân tử ammonia với ion ammonium, nhận định nào sau đây là đúng?
A. Đều chứa liên kết ion.
B. Đều có tính acid yếu trong nước.
C. Đều có tỉnh base yếu trong nước.
D. Đều chứa nguyên tử N có số oxi hoá là -3.
Câu 5. Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
A. NaCl.
B. Na2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá - khử?
A. KBr. B. NaCl. C. CaF2 D. CaCO3.
Câu 7. Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác nào sau đây đề đảm bảo an toàn?
A. Rót từ từ acid vào nước.
B. Rót nhanh acid vào nước.
C. Rót từ từ nước vào acid.
D. Rót nhanh nước vào acid.
Câu 8. Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
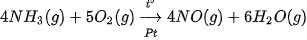
a) Tính 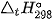 của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là 45,9 kJ/mol; 91,3 kJ/mol và -241,8 kJ/mol.
b) Tính năng lượng liên kết trong phân tử NO.
Biết năng lượng liên kết N-H, O=O, O-H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.

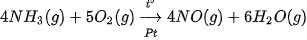
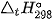 của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?